PERÍODOS
Na tabela atual os elementos químicos ocupam sete linhas horizontais que são denominados de períodos. Estes períodos são numerados ou ordenados de cima para baixo para melhor identificá-los.
Podemos associar o período de um elemento químico com a sua configuração eletrônica. O número de ordem do período de um elemento é igual ao número de níveis eletrônicos que ele elemento possui.
Exemplos:
O elemento flúor tem 9 elétrons.
A sua distribuição eletrônica é: K = 2 L = 7
Possui deste modo apenas os níveis 1 e 2 ou K e L com elétrons ( 2 níveis de energia ) então este elementos localiza-se no segundo período da classificação periódica.
O elemento potássio tem 19 elétrons.
A sua distribuição eletrônica é: K = 2 L = 8 M = 8 N = 1
Possui deste modo apenas os níveis 1, 2, 3 e 4 ou K, L, M e N com elétrons ( 4 níveis de energia ) então este elementos localiza-se no quarto período da classificação periódica.
FAMÍLIAS (GRUPOS ou COLUNAS)
Constituem as 18 linhas verticais da classificação periódica. Estas linhas são numeradas de 1 a 8 e subdivididas em A e B (a IUPAC recomenda que esta numeração seja de 1 a 18).
Os elementos que estão no subgrupo A são denominados de representativos e os do subgrupo B de transição.
Para os elementos REPRESENTATIVOS a sua família é identificada pelo total de elétrons na camada de valência (última camada).
Exemplos:
O cloro tem 17 elétrons.
K = 2 L = 8 M = 7
Observamos que ele possui 7 elétrons na última camada, então, se encontra na família 7A da classificação periódica.
Exemplos:
O cálcio tem 20 elétrons.
K = 2 L = 8 M = 8 N = 2
Observamos que ele possui 2 elétrons na última camada, então, se encontra na família 2A da classificação periódica.
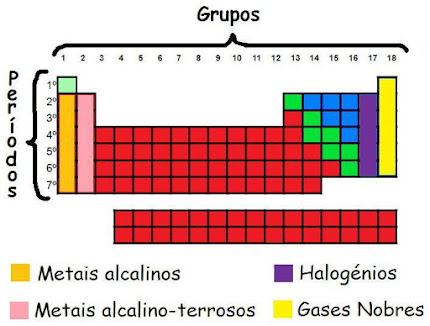
NOMES ESPECIAIS PARA AS FAMÍLIAS
Algumas famílias da classificação periódica têm uma denominação especial.
Famílias identificadas por nomes especiais.
1A: Família dos metais alcalinos.
Li, Na, K, Rb, Cs e Fr.
2A: Família dos metais alcalinos terrosos.
Be, Mg, Ca, Sr, Ba e Ra.
6A: Família dos Calcogênios.
O, S, Se, Te e Po.
7A: Família dos Halogênios.
F, Cl, Br, I e At.
O : Família dos Gases nobres.
He, Ne, Ar, Kr, Xe e Rn